随着生物医学技术的飞速发展,牙齿再生这一曾被视为“科幻”的概念正逐步走向现实。近年来,干 细胞技术、3D生物打印、基因编辑等领域的突破性进展,为牙齿再生提供了科学依据。
然而,这一技术的临床应用仍面临技术成熟度、伦理争议、成本等多重挑战。本文将结合2025年新科研动态,解析再生牙齿技术的现状、瓶颈与未来展望。
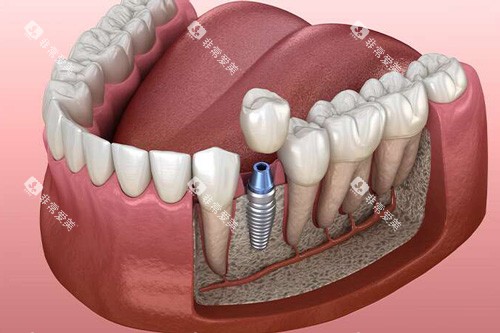
1. 药物干预与蛋白质调控
日本科学家在京都大学医院启动的“牙齿再生药物”临床试验成为焦点。
该研究基于对“USAG-1”蛋白质的抑制作用,通过单克隆抗体药物(如TRG035)诱导小鼠长出完整牙齿。
实验数据显示,单次注射可使小鼠在6周内生成与天然牙齿形态、功能相似的新牙。若临床试验顺利,该药物有望在2030年前量产,但需通过FDA等监管机构审批,时间可能延长至2035年。

2. 3D生物打印与干 细胞技术
日本东京齿科大学研发的“牙胚3D培养系统”已实现体外培育功能性牙齿,单颗牙齿培养周期缩短至6周,移植存活率达92%。美国哈佛大学团队开发的仿生牙本质支架(BioDentrix)通过FDA一期临床,其多孔结构支持宿主细胞浸润再生,动物实验显示8周内完成牙体再生。
这些技术表明,再生牙齿的体外培育与移植已具备可行性,但成本高昂(单颗牙齿培养成本约3-5万美元)和形态匹配误差(>15%)仍是商业化障碍。
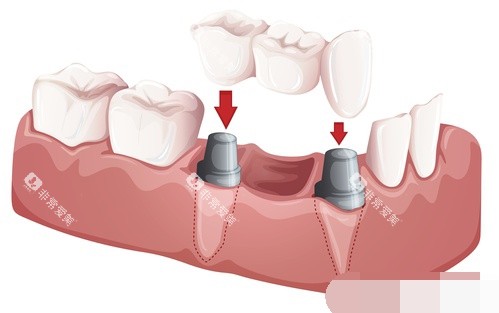
3. 基因编辑与材料科学
CRISPR-Cas12i系统在牙釉质再生领域取得突破,成功修复小鼠牙釉质发育缺陷基因。
我国研究人员利用基因编辑技术将CRISPR-Cas9装入益生菌,试图通过口腔菌群调控牙齿再生。
此外,生物材料如羟基磷灰石纳米颗粒、丝素蛋白等被用于构建牙本质-牙釉质复合结构,为牙齿再生提供支架。
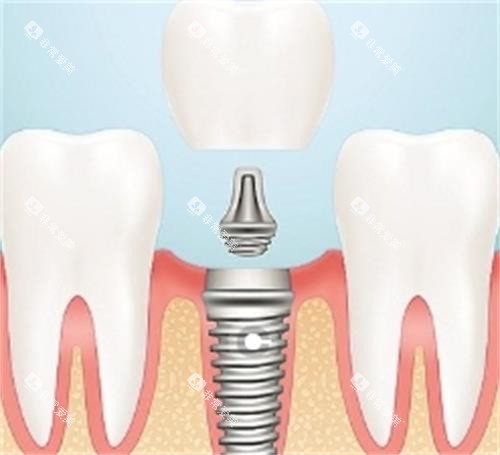
1. 技术成熟度与可靠性
目前实验主要限于动物模型,人体临床试验仍处于早期阶段。例如,美国FDA暂停了EnamelGen试剂的临床试验,因实验鼠肝脏中检出磷酸钙结晶,凸显了纳米载体代谢风险。此外,干 细胞技术的基因调控可能引发不可预测的生物风险,需长期健康性评估。
2. 伦理与法律争议
胚胎干 细胞来源的伦理争议持续,2024年欧盟已立法限制相关研究。即便采用诱导多能干 细胞(iPSCs),其制备过程仍需严格监管,避免细胞癌变风险。
3. 成本与普及性
再生牙齿技术初期费用可能高达数十万元,远超种植牙(约1-3万元)。医疗技术评审机构(IMDRF)尚未建立统一标准,各国审批流程差异导致产品上市滞后。
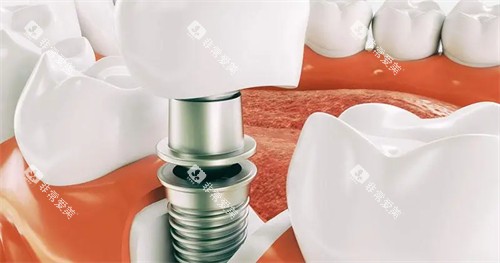
基于2025年研究数据,技术普及将分三阶段推进:
2026-2030年:
实验室技术向临床转化,重点突破形态匹配与成本控制。例如,AI驱动的生物打印技术(如Organovo公司的DentoPrint系统)可能将单颗牙齿培养成本降至1万美元以下。
2031-2040年:
完成大规模临床试验,建立标准化审批流程。预计2035年前后,再生牙齿技术将首先应用于儿童乳牙缺失或先天性缺牙病例。
2041-2050年:
技术成熟后逐步替代种植牙,成为主流修复方式。但需解决牙髓血管神经再生、牙周膜重建等复杂问题。
1. 替代方案
种植牙:作为目前比较成熟的修复方式,稳定性高,但需依赖牙槽骨健康。
牙髓冻存服务:成本约8000元/年,为未来再生技术储备干 细胞资源。
2. 未来准备
参与临床试验:如日本京都大学的“牙齿再生药物”试验,可提前获得新技术治疗机会。
建立口腔健康档案:记录牙齿发育、龋齿史等信息,为个性化再生治疗提供依据。
1. 医疗行业变革
若再生牙齿技术普及,种植牙厂商将面临转型压力,牙科诊所可能增设“牙齿再生中心”。同时,生物材料、干 细胞研究等相关产业将迎来爆发式增长。
2. 伦理与公平性
高昂的初期费用可能导致技术垄断,加剧医疗资源分配不均。需通过政策、慈善基金等方式降低患者负担。
3. 人类认知的颠覆
“牙齿脱落”这一自然现象可能被技术干预,引发关于“人类进化”的哲学讨论。例如,若80岁老人拥有20岁的牙槽骨密度,是否需重新定义“衰老”?
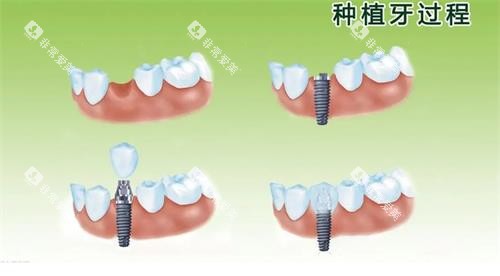
2025年,再生牙齿技术已从实验室走向临床,药物干预、3D打印、基因编辑等领域取得突破性进展。然而,技术成熟度、伦理争议、成本等问题仍需时间解决。
乐观预测:2030-2035年,部分再生牙齿技术可能实现临床应用,首先惠及儿童与先天性缺牙患者。
现实挑战:全方面普及或需至2050年,需突破牙髓血管再生、成本控制等瓶颈。
对于普通消费者而言,当前应优先选择种植牙等成熟技术,同时关注再生医学进展。未来,随着技术突破与政策完善,人类或迎来“第二次长牙”的生命奇迹。
建议:
保持口腔卫生,定期检查,预防牙齿缺失。
参与再生医学临床试验,为技术进步贡献力量。
理性看待技术发展,避免盲目追求“未成熟疗法”。
再生牙齿技术的未来充满希望,但需以科学态度与人文关怀共同推动其走向成熟。
· 相关阅读 ·